Elektrochemická řada napětí kovů
(Beketovova řada kovů)
Sestavíme-li řadu kovů podle rostoucích hodnot standardních elektrodových potenciálů, dostáváme řadu napětí kovů.
Protože z umístění kovu v řadě napětí lze vyvodit jeho chování v redoxních reakcích, je užitečné tuto řadu aspoň pro nejvýznamnější kovy znát zpaměti. Její zapamatování není s mnemotechnickou pomůckou problém.
Neúplná řada napětí kovů:
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H Cu Ag Hg Pt Au
Citlivé povahy nechť prominou použití expresivních výrazů, které zde plní neocenitelnou službu při zapamatování si této řady 22 kovů setříděných podle rostoucí ušlechtilosti.
Mnemotechnickou pomůckou je popis události z bouřlivého večírku:
Lída Karasová Bruta´lně Sežraná Ca´kla Na Magnetofon Alkoholu Mnoho Značky Citrusový Fernet Co s Nim Snad Poběží. HovnoCuc Argumentuje Hygienou Platinového Automobilu.
-
Kovy v řadě jsou seřazeny podle stoupajících hodnot standardních elektrodových potenciálů.
-
Kovy stojící v řadě nalevo od vodíku se nazývají kovy neušlechtilé, kovy stojící napravo jsou kovy ušlechtilé.
-
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H Cu Ag Hg Pt Au
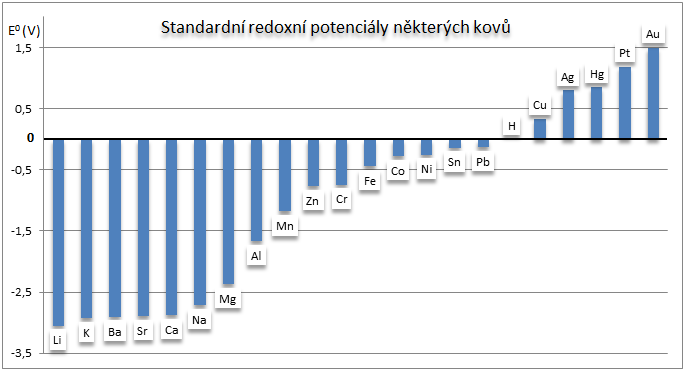
Obr. 1: Porovnání hodnot standardních redoxních potenciálů některých kovů
-
Neušlechtilé kovy mají E0 < 0, snadno tvoří kationty, např. E0 (Na+/Na) = –2,714 V.
-
Ušlechtilé kovy mají E0 > 0, např. E0 (Au3+/Au) = +1,420 V.
-
Redukční schopnosti prvků klesají v řadě směrem zleva doprava.
-
Prvek stojící v řadě vlevo působí jako redukční činidlo na ionty prvků stojících od něj napravo.
-
To znamená, že kovy stojicí v řadě více vlevo mohou vytěsnit kovy stojící od nich napravo z roztoků jejich iontů.
Například:iontový zápis: Fe + Cu2+ → Fe2+ + Cu úplný zápis: Fe(s) + CuSO4 (aq) → FeSO4 (aq) + Cu(s) iontový zápis: Zn + Pb2+ → Zn2+ + Pb úplný zápis: Zn(s) + Pb(NO3)2 (aq) → Zn(NO3)2 (aq) + Pb(s) iontový zápis: Cu + 2 Ag+ → Cu2+ + 2 Ag úplný zápis: Cu (s) + 2 AgNO3 (aq) → Cu(NO3)2 (aq) + 2 Ag(s)
-
Pouze kovy, které jsou od vodíku nalevo, jsou schopny jej vytěsnit z kyselin.
2 Na + H2O → H2 + 2 NaOH
Zn + 2 HCl → H2 + ZnCl2
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 -
Kationty kovů stojících od vodíku napravo mají schopnost zoxidovat vodík.
Vodík redukuje kationty ušlechtilých kovů na elementární kov:
CuO + H2 → Cu + H2O -
Zleva doprava klesá reaktivita kovů vůči vodě a kyselinám:
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H Cu Ag Hg Pt Au
– Od lithia po sodík reagují s vodou za studena za vzniku vodíku a příslušného hydroxidu,
např. sodík reaguje prudce: 2 Na + 2 H2O → 2 NaOH + H2.
– Od hořčíku po železo reagují s vodní párou za vzniku vodíku a hydroxidů nebo oxidů kovů,
např.:hořčík Mg + 2 H2O → Mg(OH)2 + H2 mangan Mn + 2 H2O → Mn(OH)2 + H2 chrom 2 Cr + 3 H2O → Cr2O3 + 3 H2
– S neoxidujícími kyselinami reagují všechny neušlechtilé kovy na vodík a sůl dané kyseliny.
– Kobalt a nikl se ve zředěných kyselinách rozpouštějí jen neochotně a pomalu, v koncetrované HNO3 se pasivují.
– Cín se ochotně rozpouští v koncentrované HCl za přítomnosti malého množství oxidačních činidel (HNO3, H2O2).
– Olovo se dobře rozpouští v kyselině dusičné HNO3, ale v koncentrované kyselině sírové se pasivuje. -
Ušlechtilé kovy reagují pouze s kyselinami se silnými oxidačními účinky,
např.
Cu, Ag, Hg reagují s HNO3 nebo s H2SO4, ale zlato ani platina s těmito kyselinami nereagují.
Au a Pt reagují s lučavkou královskou.
Ušlechtilé kovy nemohou vyredukovat z kyselin vodík, ale reagovat s kyselinami s oxidačními účinky mohou.
Například měď je koncentrovanou kyselinou dusičnou oxidována na měďnatou sůl a tím se kyselina dusičná redukuje na oxid dusičitý:
Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O.
Průběh této reakce můžete sledovat z tohoto odkazu: -
Cu s kyselinou chlorovodíkovou nereaguje, protože HCl nemá oxidační účinky (chlor je ve svém nejnižším oxidačním stupni –I, a nemůže se proto již více redukovat)
Vyznačíme-li prvky z Beketovovy řady v periodické tabulce pomocí pořadových čísel, vidíme umístění kovů s největšími redukčními účinky i umístění ušlechtilých kovů.
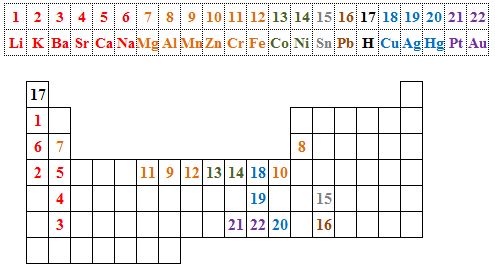 |
| Obr. 2: Umístění prvků Beketovovy řady v periodické tabulce prvků |
Zdroje
- GREENWOOD; EARNSHAW. Chemie prvků. Praha: Informatorium, 1993, ISBN 80-85427-38-9.
- HONZA, Jaroslav a Aleš MAREČEK. Chemie pro čtyřletá gymnázia 2. díl. BrnDaTaPrintBrno, 1996, 256 s. ISBN 80-902200-4-5.
- http://cs.wikipedia.org/wiki/George_de_Hevesy
- http://www.prvky.com
Obrázky
- Obr. 3: OCTAVIUM. http://cs.wikipedia.org/wiki/Nikolaj_Nikolajevi%C4%8D_Beketov [online]. [cit. 1.11.2014]. Dostupný na WWW: http://cs.wikipedia.org/wiki/Nikolaj_Nikolajevi%C4%8D_Beketov#mediaviewer/File:Beketov01.jpg
- Obr. 4: Autor neznámý. http://en.wikipedia.org/wiki/George_de_Hevesy [online]. [cit. 1.11.2014]. Dostupný na WWW: http://upload.wikimedia.org/wikipedia/commons/thumb/b/b4/George_de_Hevesy.jpg/200px-George_de_Hevesy.jpg
- Pokud není uvedeno jinak, autorem obrázků je Jaroslav Svatoň
Přílohy
Osobnosti
Nikolaj Nikolajevič Beketov (1827–1911)

|
| Obr. 3: N. Beketov |
Ruský chemik, profesor na univerzitě v Charkově, který na základě reakce s kyselinami rozdělil kovy na ušlechtilé a neušlechtilé. Podle jejich vzájemných reakcí je pak seřadil do řady kovů podle reaktivity.
Svými experimenty také přispěl k aplikaci aluminotermie jako metody získávání kovů.
Kontrolní otázka
- Které kovy se nazývají neušlechtilé a které ušlechtilé?
- Který z dvojice kovů zinek – mangan je ušlechtilejší?
- Je cín ušlechtilejším kovem než kobalt?
- Lze pomocí kovového hořčíku vyredukovat stroncium z roztoku jeho iontů strontnatých?
- Bude při reakci hliníku s kyselinou chlorovodíkovou vznikat vodík?
- Rozpouští kyselina chlorovodíková měď?
- Proč se hořící hořčík nedá hasit vodou?
Zajímavost

|
| Obr. 4: G. Hevesy |
Za druhé světové války během německé invaze do Dánska použil lučavku královskou nebývalým způsobem německý chemik maďarského původu György Hevesy, objevitel prvku hafnium a držitel Nobelovy ceny za radiochemii (1943). Před svým nuceným odchodem do Švédska v ní rozpustil dvě zlaté medaile Nobelových cen pro Maxe von Laue a Jamese Francka, aby je nacisté neukradli. Roztok položil na polici ve své laboratoři v Institutu Nielse Bohra. Po válce se vrátil, našel roztok neporušený a vysrážel z něj zlato zpět. Nobelova společnost pak znovu odlila medaile z původního zlata.
Základní pojmy
Pasivace kovu – vytvoření kompaktní vrstvy stabilní sloučeniny na povrchu kovu, která zabraňuje jeho korozi. Samovolná pasivace – probíhá samovolně, například povrch hliníku je pokryt kompaktní... Zobrazit víceDoplňující učivo
Lučavka královská
Směs koncentrovaných kyselin dusičné a chlorovodíkové v poměru 1:3, která rozpouští kov králů – zlato.
Na rozpouštění zlata obě kyseliny, HNO3 a HCl, spolupracují.
Kyselina dusičná má extrémně silné oxidační schopnosti, které způsobí rozpuštění velmi malého množství zlata za vzniku kationtů zlatitých Au3+ .
Au + 3NO3- + 6 H+ ⇄ Au3+ + 3 NO2 + 3 H2O
Bez přítomnosti HCl by se ustavila chemická rovnováha velmi výrazně posunutá ve prospěch kovového zlata.
Chloridové ionty ovšem vytváří s kationty Au3+ z roztoku velmi stabilní komplexní anionty tetrachlorozlatitanové [AuCl4]-.
Au3+ + 4 Cl- → [AuCl4]-
Tím se koncentrace kovových iontů v roztoku snižuje a toto porušování rovnováhy vede k dalšímu uvolňování kationtů Au3+ z kovového zlata, a tedy jeho dalšímu rozpouštění.
Úkol
- Zapište rovnici reakce vápníku s vodou.
- Vyčíslete rovnici aluminotermické reakce oxidu manganato-manganitého
Mn3O4 + Al → Mn + Al2O3.
- Napište rovnici reakce hořčíku s kyselinou sírovou.
- Napište rovnici reakce mědi s koncentrovanou kyselinou sírovou.
Laboratorní cvičení
Návody k zajímavým laboratorním cvičením (od chemiků z Gymnázia Pavla Tigrida) k tématice řady napětí kovů naleznete v příloze.




